| kategória | ||||||||||
|
|
||||||||||
|
|
||
HALMAZÁLLAPOTOK
Anyagi halmazok
A termodinamikai rendszerek mindig nagyszámú kémiai részecskéböl állnak, s ún. anyagi halmazokat alkotnak. A két- vagy többfázisú rendszerek különbözö tulajdonságokkal rendelkezö halmazokból állnak. Az anyagi halmazok minöségileg más anyagformákat jelentenek, mint az azokat alkotó atomok vagy molekulák. Alapvetö fizikai tulajdonságaik szerint az anyagi halmazokat három csoportba, nevezetesen a gázok, a folyadékok és a szilárd testek közé sorolják; ennek megfelelöen gáz-, folyadék- és szilárd halmazállapotot különböztetünk meg. A hömérséklettöl és a nyomástól függöen az azonos fajta részecskékböl álló anyagi halmazok is különbözö halmazállapotban lehetnek. Megfelelö mértékü hütés hatására a gázhalmazállapotú anyagok cseppfolyósodnak, majd a további hömérsékletcsökkentés végül szilárd halmazállapotot eredményez. Kézenfekvö magyarázata ennek az, hogy a részecskék kinetikus energiája csökken, s mindinkább érvényesülnek az azok közötti kölcsönhatások. A nyomásnövelés, ha nem jár együtt jelentös felmelegedéssel, végsö soron szintén a cseppfolyósodást, majd a szilárd állapot bekövetkezését eredményezi. Ez esetben ugyancsak a kölcsönhatások válnak meghatározókká, mivel a nyomás növelésével csökken a részecskék átlagos távolsága.
Ezekben a halmazállapotokban eltérö a molekulák távolsága, azok kinetikai energiája és a molekulák közötti vonzóerö nagysága. A kinetikai energiák növelésével az alkotórészek egymástól távolodnak, erösebb molekuláris kölcsönhatások esetén viszont közelebb kerülnek egymáshoz, ezért a kinetikai energia és a molekuláris kölcsönhatások nagyságának viszonya szabja meg a halmaz részecskéi közötti átlagos távolságokat.
A részecskék kinetikai energiáját a halmaz hömérséklete, a részecskék közötti kölcsönhatásokat pedig az anyagszerkezettöl függö elsödleges vagy másodlagos kémiai kötöerök szabják meg.
Gázhalmazállapot
Gázok esetében tehát a részecskék átlagos kinetikus energiája meghaladja a részecskék közötti átlagos vonzóerö nagyságát, ezért a részecskék egymástól saját méretükhöz viszonyítva távol helyezkednek el. Ez a távolság széles tartományban változhat anélkül, hogy a részecskék közt lényeges kölcsönhatás alakulna ki, ezért a gázok összenyo 212d36c mhatók; a nyomás növelésével csökken a részecskék közötti távolság, ezért a gáz térfogata kisebb lesz. Mivel a részecskék gázhalmazállapotban nagy sebességgel mozognak, rövid idö alatt a méretüknek megfelelö távolság sokszorosát teszik meg, így a rendelkezésükre álló teret teljesen kitöltik, sürüségük kicsi, térfogat növekedéskor kiterjednek.
A tökéletes gáz kritériumai az alábbiak:
* a gázmolekulák saját térfogata a gáz által betöltött térfogathoz képest elhanyagolható,
* a részecskék az ütközésektöl eltekintve sem vonzó, sem taszító hatást nem fejtenek ki egymásra,
* az egymással vagy az edény falával történö ütközés rugalmas, (a részecskéknek az edény falával való ütközése okozza a gáz nyomását),
* a gázmolekulák sebességét és kinetikai energiáját a gáz hömérséklete szabja meg, a kinetikai energia (Ek) a következö képlettel írható le,
Ek= ![]()
ahol m = a részecskék tömege,
u = a részecskék átlagsebessége,
* azonos hömérsékleten azonos számú gázmolekula kinetikai energiája, függetlenül a gáz anyagi minöségétöl, azonos.
A reális gázok kritériumai ezzel szemben az alábbiak:
*a részecskék között fennálló kölcsönhatások nem hanyagolhatók el, így ezek esetében az általános gáztörvény csak közelítö tájékoztatást ad az állapotjelzök közötti összefüggésekröl,
*a részecskék saját térfogata a gáz által betöltött térfogathoz képest nem elhanyagolható.
Tipikusan reális gázokat képeznek a könnyen cseppfolyósítható anyagok (szén-dioxid, kén-dioxid, kloroform, klór, stb.). Permanens dipólusmomentum létezése a molekulában növeli a tökéletes gázállapottól való eltérést, és a molekulák polarizálhatósága is ebbe az irányba hat.
A kinetikus gázelmélet
A kinetikus gázelmélet szerint a részecskék állandó, rendezetlen mozgásban vannak, az egyes atomok, molekulák a tér bármely irányába egyenes vonalú mozgást végeznek mindaddig, míg az edény falával vagy egymással nem ütköznek.
Az ütközések következtében az egyes molekulák sebessége egyrészt folyton változik, másrészt a körülményektöl függöen bizonyos sebességhatárok között a legkisebb és a legnagyobb sebességet is felveheti. Az egyes molekulák sebességét külön-külön nem lehet meghatározni, de a molekulák sebességeloszlása adott hömérsékleten állandó, amit a Maxwell-Boltzmann-féle sebességeloszlási-görbével lehet leírni. Egy bizonyos hömérsékleten a görbék maximuma a legvalószínübb sebességnél van, amellyel a molekulák legnagyobb része mozog, de a gázban ennél kisebb és nagyobb sebességgel mozgó molekulák is megtalálhatók.
Statisztikailag kiszámítható az átlagos sebesség, amely a legvalószínübb sebességhez közeli érték, de azzal nem egyezik meg. A hömérséklet növelésével az eloszlási görbék maximuma és a részecskék átlagos sebessége a nagyobb sebességtartományok felé tolódik el.
A tökéletes gázok esetén a gázhalmazállapot három állapotjelzövel, a nyomással (P), a térfogattal (V) és a hömérséklettel (T) egyértelmüen jellemezhetö, azonos számú molekula (n) esetében. Az állapotjelzök egymástól függnek; két állapotjelzö a harmadikat egyértelmüen megszabja. Így pl. adott mennyiségü gáz nyomása és hömérséklete meghatározza a gáz térfogatát.
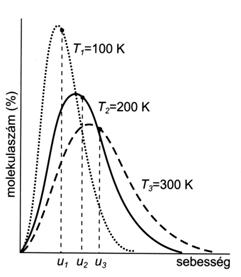
23. ábra. Azonos számú molekulát tartalmazó ideális gáz sebességeloszlása különbözö hömérsékleteken
Az állapotjelzök közötti összefüggéseket a gáztörvények írják le.
A tökéletes gázokra vonatkozó törvények (gáztörvények)
Boyle-Mariotte-törvénye:a nyomás és a térfogat összefüggése állandó hömérsékleten. Adott mennyiségü gáz nyomásának és térfogatának szorzata állandó hömérsékleten konstans:
P1 ˇ V1 = P2 ˇ V2
ahol, P1 a kezdeti állapotnak megfelelö nyomás V1 kezdeti térfogaton, melyek segítségével a végállapotban mért nyomás, P2, és a végállapotban mért térfogat, V2 , meghatározható:
P2
=![]() vagy V2 =
vagy V2 = ![]() .
.
A kinetikus gázelmélet értelmében, ha állandó hömérsékleten csökken a gáz térfogata, akkor kinetikus energiája nem változik, a térfogatcsökkenés miatt viszont ugyanazon számú és energiájú molekula gyakrabban ütközik egymással és az edény falával, melynek következtében nagyobb lesz a gáz nyomása.
Gay-Lussac-törvénye a térfogat és a hömérséklet összefüggése állandó nyomáson.
Állandó nyomáson egy adott mennyiségü gáz térfogata egyenesen arányos annak hömérsékletével. Az ideális gáz térfogatát a hömérséklet függvényében ábrázolva egyenest kapunk, mely a hömérséklet-tengelyt 0 K-nél (-273,15 oC-nál) metszi. Ez az a hömérséklet, ahol az ideális gáz megszünne létezni, azaz a térfogata nulla lenne. Egy gáz térfogata azonban soha nem lesz nulla, és ezért ezt a hömérsékletet, az abszolút nulla fokot, a lehetséges legalacsonyabb hömérsékletet, soha nem lehet elérni.
Kelvin az abszolút nulla fok ismeretében bevezette az abszolút hömérsékleti skálát (T), ami a Celsius hömérsékleti skálával (t) a következö összefüggésben van:
T = t + 273,15,
ahol T = abszolút hömérséklet, egysége K,
t = a Celsius fokokban mért hömérséklet (oC).
Gay-Lussac-törvénye szerint állandó nyomáson a gáz térfogata és abszolút hömérséklete közötti összefüggés az alábbi:
![]() .
.
A Boyle-Mariotte- és a Gay-Lussac-törvények egyesítésével a nyomás, a hömérséklet és a térfogat között összefüggés állapítható meg, melyet az egyesített gáztörvény fogalmaz meg:
![]() = állandó.
= állandó.
A gáz két különbözö állapotára pedig az alábbi összefüggés írható fel:
![]() .
.
A vegyülö gázok térfogatának viszonyai
Gay-Lussac-törvénye szerint azokban a reakciókban, ahol gázok reagálnak egymással, vagy gázhalmazállapotú termékek keletkeznek, a reagáló és a képzödö gázok térfogatai úgy aránylanak egymáshoz, mint az egyszerü egész számok.
Így pl.: 2 tf hidrogéngáz + 1 tf oxigéngáz = 2 tf vízgöz,
1 tf hidrogéngáz + 1 tf klórgáz = 2 tf sósavgáz.
Avogadro felismerve azt, hogy az arányok alapján molekulák ill. atomok is reagálhatnak egymással, törvényében (az Avogadro-törvény) kimondja, hogy azonos nyomású és hömérsékletü gázok azonos térfogatai azonos számú molekulákat tartalmaznak. Állandó nyomáson és hömérsékleten a gázok térfogata arányos a molekulaszámmal (n):
![]() .
.
Az egyetemes gáztörvény
Boyle-Mariotte-, Gay-Lussac- és Avogadro-törvényének egyesítésével le tudjuk írni a gáz 3 állapotjelzöje (P, V, T), valamint a gáz mólban kifejezett anyagmennyisége (n) közötti viszonyokat. Igy az az az egyetemes gáztörvényt leíró összefüggéshez jutunk:
PˇV = nˇRˇT.
Bármely tökéletes gáz 1 móljának térfogata 273,15 K hömérsékleten és 0,1 MPa nyomáson 22,41 dm3. A normál nyomás és hömérséklet, valamint az ezekhez tartozó normál térfogat ismeretében az R gázállandó értéke normál körülményekre vonatkoztatva az alábbi:
R
= ![]() =
= 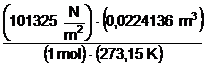 = 8,31433
JˇK-1ˇmol-1.
= 8,31433
JˇK-1ˇmol-1.
A diffúzió - Graham-törvénye
Graham-törvénye szerint ha egymástól fallal elválasztott edényben két különbözö minöségü A és B gáz van, akkor a válaszfal eltávolítása után a kétféle gáz keveredik, azaz az edény mindkét részében megtalálható. Azt a jelenséget, amikor két vagy több anyag részecskéi rendezetlen mozgásuk és ütközéseik révén homogén elegyet kialakítva keverednek, diffúziónak nevezzük. Graham-törvénye szerint a gáz diffúziójának sebessége (u) fordítottan arányos a gázok sürüségének (r) négyzetgyökével.
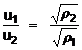 .
.
Az egyetemes gáztörvény felhasználásával egy m tömegü gáz sürüsége az alábbiak figyelembe vételével kiszámítható:
n
= ![]() ,
,
ahol m = a gáz tömege,
M = molekulatömeg.
Behelyettesítve az egyetemes gáztörvény egyenletébe:
PˇV
= ![]() ˇ Rˇ T
ˇ Rˇ T
amiböl a gáz sürüsége (r = m/V) kifejezhetö:
![]() .
.
Két különbözö gáz sürüségének viszonya azonos nyomáson és hömérsékleten:
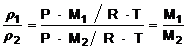 ,
,
amit a Graham-törvény egyenletébe helyettesítve:
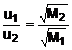 ,
,
vagyis, a gázok diffúziójának sebessége fordítottan arányos a gáz molekulatömegének négyzetgyökével. Fenti képlet segítségével a diffúziósebesség alapján a gázok molekulatömege meghatározható.
24. ábra. A diffúzió gázelegyekben
Gázelegyek, Dalton-törvénye
A gázok diffúziója során keletkezett gázelegyek nyomását a gázelegyben lévö eltérö minöségü részecskéknek az edény falával történö ütközése alakítja ki. Az elegy mindegyik összetevöje rendelkezik egy parciális (részleges) nyomással. Mivel a különbözö részecskék közt nincs kölcsönhatás, az egyes gázok parciális nyomása akkora, mintha a rendelkezésre álló teret a többi komponenstöl függetlenül töltené ki azonos hömérsékleten és nyomáson. Dalton-törvénye szerint a gázelegy nyomása egyenlö az elegyet alkotó gázok parciális nyomásainak összegével:
P = Pa + Pb + Pc + ..... + Pi
ahol a, b, c, i a gázelegy összetevöit jelöli.
A gázelegy valamely i komponensére nézve az egyetemes gáztörvényt alkalmazva:
Pi ˇ V = ni ˇ R ˇ T
ahol ni az i komponens anyagmennyisége,
Pi pedig az i komponens parciális nyomása, amely az i komponens xi=ni/Sn móltörtjének és a gázelegy P össznyomásának a szorzata:
Pi = xi P.
Reális gázok
Az elözöek során ismertetett gáztörvények alapján számított értékek csak akkor egyeznek meg a mérési adatokkal, ha a gáz tökéletes gázként viselkedik. A kinetikus gázelméletben ismertetettek szerint alacsony nyomáson és magas hömérsékleten minden gáz tökéletes gázként viselkedik. Alacsony hömérsékleten és nagy nyomáson azonban a mért adatok eltérnek a gáztörvényekböl számítottaktól; a gáz reális gázként viselkedik. Ilyen körülmények között a gáz térfogata annyira csökken, hogy a molekulák saját térfogata már nem lesz elhanyagolható a gáz által betöltött térfogathoz képest. Ezért a gáz által rendelkezésre álló térfogat a molekulák által elfoglalt térfogattal kisebb lesz a gáztartály teljes térfogatánál.
A nyomás nagymértékü növelésekor a térfogat kisebb mértékben csökken az ideális gáztörvény alapján vártnál. Mivel még a kémiailag indifferens nemesgázok is cseppfolyósíthatók, ezért a gázmolekulák között ható eröket nem lehet elhanyagolni. Van der Waals, felismerve az intermolekuláris erök jelentöségét, megalkotta a reális gázok tulajdonságainak leírására az ún. van der Waals-féle állapotegyenletet:
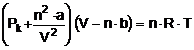 ,
,
ahol, a és b az ún. van der Waals-állandók, melyek jellemzök az anyagi minöségre,
n pedig a gáz anyagmennyisége (mol).
Különbözö gázok esetében az egyetemes gáztörvénytöl való eltérés a molekulák közötti kölcsönhatások különbségével magyarázhatók. A nagyobb molekulák között nagyobb a másodlagos kölcsönhatások valószínüsége, melynek következtében akadályozzák a felülettel történö ütközést, csökkentve ezzel a gáz nyomását.
A nyomás csökkenése annál nagyobb, minél nagyobb az anyagmennyiség (n), fordítottan arányos a térfogat négyzetével, és függ az anyagi minöségre jellemzö állandótól (a). Ezért a kísérletileg talált kisebb nyomást (Pk) egy n2 a/V2 tényezövel meg kell növelni, hogy elérjük az ideális gáztörvény szerinti nyomást (az egyenlet baloldalának elsö tényezöje):
P
=![]() .
.
A nyomás növelésével a gáz térfogata kisebb lesz és közelíti a gáz saját térfogatát. A reális gázok térfogatának számításánál ezért figyelembe kell venni az anyagmennyiséget (n) és a gáz minöségére jellemzö állandót (b), melyek segítségével a gáz rendelkezésére álló üres térfogat:
Vü = V - n ˇ b
(az egyenlet bal oldalának második tényezöje) ahol, V az edény térfogata, ami azonos az ideális gáz térfogatával.
Folyékony és szilárd halmazállapot
A folyékony és szilárd halmazállapot esetén az azokat felépítö részecskék sebesség- és energia eloszlásának jellemzésére a molekulák kinetikus elmélete alkalmazható, mivel a részecskék folyékony vagy szilárd halmazállapotban is állandó mozgásban vannak. A kinetikus elmélet szerint a folyékony, ill. szilárd halmazállapot jellemzöi az alábbiak:
* a részecskék között számottevö a vonzóerö,
* a vonzó és a taszítóerök egyensúlyának megfelelöen a részecskék meghatározott távolságban helyezkednek el egymástól,
* a folyadékok és a szilárd testek térfogata viszonylag állandó, és nagy eröhatásokra is csak igen kismértékben változik,
* a részecskék kinetikai energiája a folyadékokban is, és a szilárd anyagokban is az abszolút hömérséklettel arányos.
A folyadék és a szilárd halmazállapot közötti alapvetö különbség a részecskék mozgási szabadságában van. A folyadékokban a részecskék állandó, rendezetlen mozgásban vannak, amit bizonyít a folyadékok diffúziója, párolgása és könnyen bekövetkezö alakváltozása. A szilárd anyagok részecskéi rögzítettek, legfeljebb rezgömozgást végeznek, háromdimenziós szerkezetet alakítanak ki, és térfogatuk, valamint alakjuk is állandó.
Hömérséklet-változás hatására az anyagok halmazállapota megváltozik. A halmazállapot- változások a molekulák kinetikus elmélete segítségével értelmezhetök. Gázhalmazállapotban a molekulák kinetikus energiája elegendö a molekulák közötti vonzóerök leküzdéséhez. Csökkentve a gáz hömérsékletét, a kinetikai energia csökkenésével a vonzóerök révén a molekulák közel kerülnek egymáshoz, a gáz kondenzálódik, kialakul a folyékony halmazállapot. A hömérséklet további csökkenése a kinetikai energia és a molekuláris mozgások további csökkenésével jár, melynek hatására a folyékony anyag megszilárdul. A kinetikai energia eloszlásának változását vizsgálva a hömérséklet függvényében megállapítható, hogy a molekulák kis hányada az átlagosnál nagyobb kinetikai energiával bír, ami elegendö a szilárd vagy a folyékony állapotból a gázhalmazállapotba történö átmenethez. Ezek mennyisége az anyagok nagy részénél az esetek többségében elhanyagolhatóan kicsi.
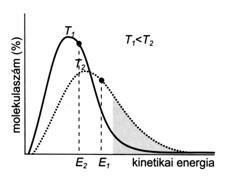
25. ábra. A kinetikai energia hömérséklet függése
A folyadékok gázhalmazállapotúvá történö átalakulását párolgásnak, a szilárd anyagok gázhalmazállapotúvá történö átalakulását - a cseppfolyós állapot kihagyásával - szublimációnak hívjuk. A szublimáció és a párolgás következtében a szilárd ill. a folyékony fázis felett göznyomás alakul ki. A hömérséklet emelésével növekszik az átlagosnál nagyobb kinetikai energiájú molekulák száma, melyek eltávoznak a göztérbe. A nyitott edényben a folyadékok egésze idövel teljes mértékben elpárolog, zárt edényben viszont a folyadék- és a göztérben lévö molekulákra is egyaránt jellemzö lesz a kinetikai energiák Maxwell-Boltzmann-féle eloszlása. Minél nagyobb lesz a molekulák száma a gözfázisban, annál több csapódik ki, és minél nagyobb lesz a molekulák kinetikai energiája a folyadékfázisban, annál több párolog el, kerül gözfázisba. Idövel a folyadék- és gözfázis egyensúlyba kerül, vagyis idöegység alatt ugyanannyi molekula kerül gözfázisba, mint amennyi onnan visszajut. A folyadékkal egyensúlyban lévö telített göz nyomását egyensúlyi göznyomásnak vagy tenziónak nevezzük.
Ugyanaz az anyag szilárd halmazállapotban kisebb tenziójú, mint folyékony halmazállapotban, tehát ugyanazon szilárd anyagok szublimációjakor a göznyomás lényegesen kisebb, mint a folyadéka feletti göznyomás. A szilárd anyagok megfelelö melegítés hatására elöször általában megolvadnak (olvadáspont), majd bizonyos hömérsékleten forrásba jönnek (forráspont). A forráspont az a hömérséklet, amelyen a folyadék tenziója egyenlövé válik a külsö nyomással. A normális forrásponton a folyadék göznyomása 0,1 MPa.
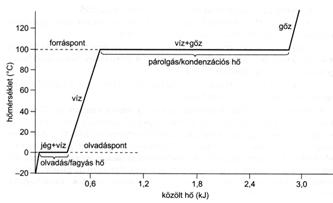
26.
ábra.
Egy anyag hevítési és lehülési görbéi megegyeznek egymással. A különbség csak annyi, hogy a hevítés során történö halmazállapot-változások höt igényelnek, míg a lehülés höfelszabadulással jár. Ezért az olvadáspont és a fagyáspont megegyezik, és a moláris olvadáshö, valamint a moláris fagyáshö értéke is azonos. Ehhez hasonlóan a forrás is és a göz halmazállapotú anyag kondenzációja is ugyanazon a hömérsékleten következik be, és a párolgáshö, valamint a kondenzációs hö is azonos.
Halmazállapot-változások hömérséklet- és nyomásfüggése
Az anyag különbözö halmazállapotokban eltérö fizikai fázisokat képez, melyek makroszkopikus határfelületeken érintkeznek egymással. A halmazállapot-változások fázisátmenettel járnak, melyek nyomástól és hömérséklettöl való függése fázisdiagrammal jellemezhetö. A kémiailag tiszta, egykomponensü anyagok fázisdiagramja 3 mezöböl áll, mely a 3 különbözö halmazállapotnak felel meg. A szilárd és a gáz mezöt a párolgási-kondenzációs (sz), a szilárd és a folyékony mezöt az olvadási-kristályosodási (fagyási) görbék (f) választják el egymástól. A görbék mentén kétféle halmazállapot van egyensúlyban egymással; a görbék metszését hármaspontnak hívjuk, ahol az anyag gáz, folyékony és szilárd formája egyensúlyban van.
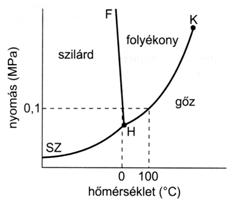
27. ábra. A víz nem méretarányos fázisdiagramja
Az olvadás és fagyáspont (H) az a hömérséklet, amelynél 0,1 MPa nyomáson az anyag szilárd és folyékony halmazállapotú formájának göznyomása megegyezik. A forrásponton a folyadék göznyomása eléri a 0,1 MPa légköri nyomást.
Ha a folyadék hömérsékletét a forráspont fölé emeljük, a kritikus pontban (K) a folyadék és a göz sürüsége egyenlövé válik, a fázishatár eltünik. A kritikus pontban mérhetö nyomás és hömérséklet a kritikus nyomás és a kritikus hömérséklet. A kritikus hömérséklet alatt az anyag gözként viselkedik, és a nyomás növelésével cseppfolyósítható. A kritikus hömérséklet felett a gázként viselkedö anyag még nagy nyomáson sem cseppfolyósítható. A hármaspont abban különbözik az olvadás- és fagyásponttól, hogy annál három, az olvadásponton viszont csak két fázis van egyensúlyban egymással. Az anyagok közül némelyek (mint pl. a szilárd szén-dioxid (száraz jég)) melegítés hatására szublimálnak, mert a szilárd fázis göznyomása egyenlö lesz 0,1 MPa nyomással mielött megolvadna. Azt a hömérsékletet, amelyen a szilárd anyag göznyomása egyenlö lesz az atmoszférikus nyomással, az anyag szublimációs pontjának hívjuk. Az olvadáspont csak kismértékben függ a nyomástól, ezért az olvadási-kristályosodási görbe a legtöbb anyag esetében párhuzamos a nyomástengellyel. Ezzel szemben a szublimációs és a párolgási- kondenzációs görbék jelentösen eltérnek az olvadási-kristályosodási görbétöl, jelezve, hogy a szublimációs és forráspontra a nyomás nagy hatást gyakorol. Csökkenö külsö nyomás esetében az anyagok szublimációja alacsonyabb hömérsékleten is végbemegy, mely összefüggés alapját képezi a fagyasztva szárításnak vagy más néven a liofilezésnek.
A folyadékok tulajdonságai
A folyadékok viszkozitása, vagy más néven belsö súrlódása, azzal a nyíróerövel arányos, amely a két egymástól egységnyi távolságra lévö folyadékréteget egymáshoz képest egységnyi sebességgel mozdítja el. A viszkozitás tehát a folyadékrétegek egymáson történö elmozdulásával szembeni ellenállást fejezi ki.
A felületi feszültség azáltal jön létre, hogy a folyadék felületén lévö részecskékre csak a folyadék belseje felöl érvényesül számottevö vonzás, míg a folyadék belsejében lévö molekulákat a környezö molekulák minden irányból azonos erövel vonzzák. A felületi feszültség, mely a folyadék felületét csökkenteni igyekszik, azzal az energiával azonos, mely a folyadék felületének egységnyi területtel való megnöveléséhez szükséges.
A folyadékok göznyomása a hömérséklet emelésével exponenciálisan nö. Az eltérö intermolekuláris kölcsönhatások miatt a folyadékok göznyomása különbözö hömérsékleten éri el az atmoszférikus nyomást, ezért eltérö a forráspontjuk. A hömérséklet növelésével a viszkozitás és a felületi feszültség csökken, a göznyomás viszont növekszik. Desztillációnak hívjuk azt a müveletet, melynek során egy folyadékot elpárologtatunk, majd a gözöket lehütve kondenzáljuk. A desztilláció alkalmas egyrészt folyadékok tisztítására, az eltérö forráspontú komponensek szétválasztására és az anyagok azonosítására az atmoszférikus nyomáson mért forráspont alapján. A nyomás csökkentésével a folyadékok forrása alacsonyabb hömérsékleten következik be. Vákuumban végezve a desztillálást olyan anyagok tisztítását, ill. elválasztását is el tudjuk végezni, melyek a légköri nyomáson végzett desztilláció során elbomlanának.
A szilárd kristályos anyagok
A szilárd anyagokat szerkezeti rendezettségük alapján amorf és kristályos szilárd testekre oszthatjuk. Az amorf anyagokban az azokat felépítö részecskék szabályos térbeni elrendezödést nem mutatnak, részleges rendezettségük alapján szilárd folyadékoknak tekinthetök.
Az amorf anyagok izotrópok, tulajdonságaik azonosak a tér minden irányában. A kristályos szilárd anyagokat felépítö részecskék szabályszerü, meghatározott szerkezetü, periodikusan ismétlödö térrácsot alakítanak ki. Általában anizotrópok, homogén kémiai összetételük ellenére sajátságaik egy része (fénytörés, elektromos vezetöképesség, mágnesesség) az iránytól függ. A folyadékkristályok a kristályhoz hasonló irányfüggö sajátosságokkal rendelkeznek, a folyadékokhoz hasonlóan folynak, átmenetet képezve a folyadékok és a kristályos anyagok közt. A folyadékkristály kétdimenziós szerkezetü, a folyadékoknál nagyobb fokú rendezettséget mutat. Gyakorlati alkalmazásuk számottevö pl. számkijelzök és monitorok készítésében, de például a sejtekben található lipid kettös réteg (membrán) szerkezetét és tulajdonságait is a folyadék-mozaik modellelmélettel lehet leírni, mely a membránt rendezett folyadéknak tekinti.
A kristályos anyagokat a rácspontokban elhelyezkedö részecskék és a közöttük lévö kölcsönhatások szerint csoportosíthatjuk.
*A fémrácsok rácspontjaiban atomok ill. pozitív atomtörzsek találhatók delokalizált elektronfelhövel, a részecskék közötti kölcsönhatást a fémes kötés biztosítja (pl. a fémek és a különbözö fémötvözetek).
* Ionrács esetén a rácspontokban pozitív és negatív ionok találhatók, a részecskék közötti kölcsönhatást az ionkötés biztosítja (pl. sók, oxidok).
*Az atomrácsnál a rácspontokban atomok találhatók, a részecskék kovalens kötéssel kapcsolódnak egymáshoz (pl. gyémánt, grafit, kvarc).
*A molekularács esetében a rácspontokban molekulák találhatók, amelyek hidrogénkötéssel vagy másodlagos kötöerökkel kapcsolódnak egymáshoz (pl. jég, cukor, CO2).
A kristályos anyag tulajdonságai (keménység, nyújthatóság, vezetöképesség, olvadáspont) függnek a rácspontokban elhelyezkedö részecskéktöl és a közöttük lévö kölcsönhatásoktól. A kristályok tulajdonságai viszonylag széles határok között változnak, még azonos rácstípus esetén is. Így pl. a fémrácsot alkotó higany olvadáspontja -39 oC, a volfrámé 3410 oC, az ionrácsot alkotó cézium-klorid olvadáspontja 645 oC, a magnézium-oxidé 2800 oC. A kvarc és a gyémánt is atomrácsot alkot, ennek ellenére a kvarc olvadáspontja 1610 oC, a gyémánté 3510 oC.
A kristályok egy adott rácstípuson belül is különbözhetnek a felépítö részecskék térbeni elhelyezkedésében. Elemi cellának hívjuk a térrács azon legkisebb egységét, amelynek szabályos ismétlödéseivel a kristályrács felépül. Amikor kémiailag különbözö anyagok azonos kristályrácsot alakítanak ki, izomorfiáról, amikor egy anyag többféle kristályrácsot is alkothat, polimorfiáról, ha az anyag kémiai elem, akkor allotrópiáról beszélünk. A polimorf vagy allotróp módosulatok sok esetben jelentösen különbözhetnek fizikai-kémiai tulajdonságaikban, mint azt a gyémánt és a grafit tulajdonsága is mutatja. A gyémánt tiszta, színtelen, rendkívül kemény anyag és az elektromos áramot nem vezeti. A szénatomok közt létrejövö tetraéderes irányultságú s-kötések térrácsot alkotnak. A grafit szénatomjai három s- és egy p-kötést létesítenek; ezáltal olyan rétegek jönnek létre, amelyekben a s-kötések egy síkban helyezkednek el, mely síkokat a delokalizált p-elektronok tartják össze. A grafit fekete, kis sürüségü, lágy és az elektromos áramot jól vezeti.
Sokáig azt hitték, hogy a szénnek csak a gyémánt és a grafit a stabilis módosulata, mígnem 1985-ben elöállították a C60 fullerént, amelyet öt- és hattagú, egymással kapcsolódó szénatomokból álló gyürük építenek fel, futballabdához hasonló szerkezetet kialakítva. Késöbb elöállították a C70, C76, C84, ... fulleréneket, bizonyítva a szén nagyszámú allotróp módosulatának létezését.
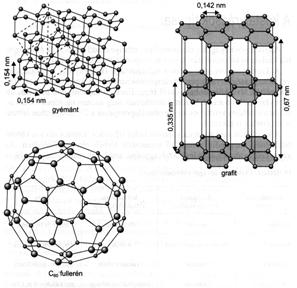
28. ábra. A gyémánt és a grafit kristályrácsa, valamint a C60 fullerén
Találat: 10728