| kategória | ||||||||||
|
|
||||||||||
|
|
||
SAVAK, BÁZISOK ÉS SÓK
Elektrolitok és az elektrolitos disszociáció
 Az elektrolitok olyan anyagok, amelyekben az
ionos vegyületek alkalmas oldószerben feloldva (vagy oldószer nélkül csak
megolvasztva) részben vagy egészben pozitív és negatív töltésü
részecskékre, kationokra és anionokra bomlanak az elektrolitos disszociáció
során.
Az elektrolitoldatok makroszkópikus mennyiségében az ellentétes
elöjelü iontöltések mindig kiegyenlítik egymást (elektroneutralitás
tétele).
Az elektrolitok olyan anyagok, amelyekben az
ionos vegyületek alkalmas oldószerben feloldva (vagy oldószer nélkül csak
megolvasztva) részben vagy egészben pozitív és negatív töltésü
részecskékre, kationokra és anionokra bomlanak az elektrolitos disszociáció
során.
Az elektrolitoldatok makroszkópikus mennyiségében az ellentétes
elöjelü iontöltések mindig kiegyenlítik egymást (elektroneutralitás
tétele).
43. ábra. Az elektromos áram vezetése elektrolitokban
Az elektrolitoldatok az ún. másodfajú vezetök közé tartoznak, ami alatt azt értjük, hogy az elektromosságot ionok szállítják. (Ellentétben az elsöfajú vagy fémes vezetökkel, amelyekben ezt a funkciót a potenciálkülönbség hatására elmozduló elektronok töltik be). Kémiai értelemben az elektrolitok a savak, a bázisok vagy a sók közé sorolhatók, így az ún. elektrolit egyensúlyok tulajdonképpen sav-bázis egyensúlyokat jelentenek.
Az elektrolitos disszociáció mértéke az anyagi minöség 636j93g , az oldott anyag és az oldószer, a hömérséklet és a koncentráció függvénye. Ha az oldott anyag túlnyomó többsége disszociált állapotban van, erös elektrolitról, ellenkezö esetben gyenge elektrolitról beszélünk. A savak és bázisok között erös és gyenge elektrolitok gyakran elöfordulnak, a sók azonban kevés kivételtöl eltekintve az erös elektrolitok közé tartoznak.
Valamely oldat adott komponensét tekintve a disszociáció mértékét az ún. disszociáció fokkal (a) jellemezhetjük. Definíció szerint:
a nd/n 0 a
ahol nd a disszociált (elbomlott) anyagmennyiség (mol),
n a kiindulási anyagmennyiség (mol).
Az elözöek értelmében az
erös elektrolitok disszociációfoka, függetlenül a koncentrációtól, gyakorlatilag
Erös elektrolitokat képeznek a viszonylag nagy polaritású kötéseket tartalmazó molekulák is. Ezek vízben történö oldása során kationokra és anionokra esnek szét a víz kötésüket polarizáló hatására. A sósavmolekulákat pl. vízbe vezetve felbomlik a hidrogén- és a klóratomok közötti kötés, és hidrogén- és kloridionok keletkeznek:
![]() HCl(g) aq H+ + Cl
HCl(g) aq H+ + Cl
Számos, vízben jól oldódó molekula kismértékben disszociál ionokra; az ecetsav 1M-os oldatában 1000 ecetsav-molekulából mindössze 4 bomlik fel CH3COO--ra és H+-ra.
![]() CH3COOH(aq)
CH3COO + H+
CH3COOH(aq)
CH3COO + H+
A víz disszociációja
A kémiailag tiszta víz csak kismértékben disszociál:
![]() H2O(l) H+
+ OH
H2O(l) H+
+ OH
A csekély disszociáció miatt a tiszta víz csak igen csekély mértékben vezeti az elektromos áramot. A H+, mint legkisebb pozitív töltésü ion, nagy polarizáló erövel rendelkezik, ezért közte valamint a vízmolekula között, annak dipólus jellege miatt, erös vonzás lép fel. Ezért vizes oldatban a H+ soha nem fordul elö, hanem H2O molekulával kapcsolódva H3O+ oxónium iont alkot. A víz disszociációjának egyenlete helyesen:
![]() H2O(l) + H2O(l) H3O+ + OH
H2O(l) + H2O(l) H3O+ + OH
A hidrogénre disszociáló anyagok vízben való oldódásának korrekt egyenletei pedig pl:
![]() HCl(l) + H2O(l) H3O+ + Cl
HCl(l) + H2O(l) H3O+ + Cl
![]() CH3COOH(l) + H2O(l) H3O+ + CH3COO
CH3COOH(l) + H2O(l) H3O+ + CH3COO
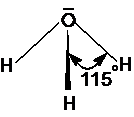
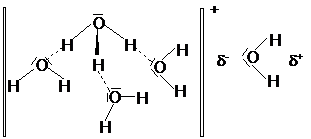
44. ábra. Az oxóniumion geometriája, és a víz kapcsolódása az oxóniumionhoz
Az oxónium ionban az atomok trigonális piramisos elrendezödést mutatnak. Vizes oldatban a H3O+-t 4 vízmolekula veszi körül, melyek közül 3 hidrogénkötéssel, 1 pedig ionos kötéssel kapcsolódik a H3O+-hoz.
Arrhenius-féle sav-bázis elmélet
Az Arrhenius-féle elmélet a savakat és a bázisokat egymástól lényegében függetlenül, és csupán vizes közeg esetén értelmezi. Ebben a felfogásban a savak ill. a bázisok olyan anyagok, amelyek vízben való oldáskor H+-ionra és savmaradék-anionra (A ), ill. bázismaradék-kationra (B+) és OH -ionra disszociálnak:
![]() HA H+
+ A
HA H+
+ A
![]() BOH B+
+ OH
BOH B+
+ OH
Az Arrhenius-féle elméletben az ionok keletkezése csupán bomlási folyamat (elektrolitos disszociáció) eredménye, így tehát a H3O+-ionok (oxóniumionok) létrejötte csupán a H+-ionok hidratációjának, tehát csak egy másodlagos folyamatnak tekinthetö. Ezen elmélet szerint a közömbösítési reakció:
HA + BOH = BA + H2O
vagyis lényegileg a vízképzödés:
H+ + OH = H2O(l)
Fogyatékosságai ellenére az Arrhenius-féle elméletet ma sem célszerü figyelmen kívül hagyni, mivel általa számos fontos egyensúlyi folyamat egyszerüen megmagyarázható, továbbá olyan lényeges fogalmak kapcsolódnak hozzá, mint pl. a pH, a pOH, a só stb. (A pH és pOH fogalom az egyensúlyoknál kerül tárgyalásra).
Arrhenius definíciója szerint savak tehát azok az anyagok, amelyek vízben hidrogénionokra és savmaradék ionokra disszociálnak, oldatuk savas kémhatású, mivel a H+ koncentrációja nagyobb, mint a OH koncentrációja:
HNO3(l) + H2O(l) = H3O+ + ![]()
H2SO4(l) + 2 H2O(l) = 2 H3O+
+ ![]()
H3PO4(l) + 3 H2O(l) = 3 H3O+
+ ![]()
HCN(g) + H2O(l) = H3O+ + CN
aq
Bázisok
pedig azok az anyagok, amelyek vizes oldatban hidroxidionokra disszociálnak,
oldatuk lúgos kémhatású, mert az OH koncentrációja meghaladja a H+
koncentrációt:
![]() NaOH(s) Na+ + OH
NaOH(s) Na+ + OH
![]() KOH(s) K+ + OH
KOH(s) K+ + OH
![]() Ca(OH)2(s) Ca2+
+ 2 OH
Ca(OH)2(s) Ca2+
+ 2 OH
Az elektrolitok erössége szerint csoportosítva a savakat és bázisokat megkülönböztethetünk erös savakat és erös bázisokat, melyek vizes oldatukban teljes mértékben disszociálnak (a
Ezzel szemben a gyenge savak és gyenge bázisok vizes oldatukban csak kismértékben disszociálnak (a<1).
Erös savak pl. a HCl, a HI, a HNO3 és a H2SO4, míg gyenge savak pl. a HF, a CH3COOH, a HCN.
Erös bázisok pl. a NaOH, a KOH, míg gyenge bázis az NH4OH.
Savak és bázisok egymás közötti reakciója a közömbösítés, ami só és víz képzödéssel jár:
HCl(aq) + NaOH(aq) = NaCl(aq) + H2O(l)
H3PO4(aq) + 3 KOH(aq) = K3PO4(aq) + 3 H2O(l)
H2SO4(aq) + Ca(OH)2(aq) = CaSO4(s) + 2 H2O(l)
A sók mindig erös elektrolitok, függetlenül attól, hogy milyen erösségü savból és bázisból keletkeznek.
A közömbösítési reakciókat a disszociált ionokkal felírva, majd az egyenlet mindkét oldalán a változatlan formában meglévö ionokat elhagyva, a közömbösítési reakció a víz ionjaiból történö képzödési reakciójára redukálódik:
H+ + OH H2O(l)
Az elektrolitok vezetöképessége
Az elektrolitok vezetöképessége az oldatban lévö ionok számától (disszociófoktól), az ion töltésétöl és mozgékonyságától függ. Az oldat vezetöképessége fordítottan arányos az ellenállással (R), amely függ a vezetö hosszától (l) és keresztmetszetétöl (A).
R
= z ˇ ![]() ,
,
ahol, z a fajlagos ellenállás, az egységnyi hosszúságú és keresztmetszetü vezetö ellenállása.
A vezetöképesség az ellenállás reciproka, azaz:
![]() .
.
A fajlagos
ellenállás reciproka a fajlagos vezetöképesség c = ![]() .
.
Az elektrolitok vezetöképességének jobb összehasonlíthatósága miatt az ekvivalens vezetöképesség (L) bevezetése szükséges, melyet a fajlagos vezetöképesség és a hígítás (V, amely az egyenértéktömegü elektrolitot tartalmazó oldat térfogata cm3-ben) szorzatából kapunk:
L c V.
Az elektrolitok ekvivalens vezetöképessége, disszociációfoka és a hígítás közötti összefüggés egy erös (sósav) és egy gyenge (ecetsav) elektrolit esetén az alábbi. Az erös elektrolitok tömény oldatban is teljes mértékben disszociálnak, ekvivalens vezetöképességük hasonló a végtelen nagy hígításnál mért értékhez.
45. ábra Erös elektrolitok tömény oldatában elöforduló kölcsönhatások
A gyenge elektrolitoknál viszont mind a disszociáció, mind a vezetöképesség tömény oldatban csak kismértékü, amely a hígítással növekszik. Végtelen nagy hígításban a gyenge elektrolitok is teljes mértékben disszociálnak, és ekvivalens vezetöképességük is maximális. Az ekvivalens vezetöképesség mérésével lehetöség van a gyenge elektrolit disszociációfokának meghatározására. Nagyon tömény elektrolitok esetében a disszociációfok és az ekvivalens vezetöképesség közötti összefüggés nem alkalmazható, mert a teljes disszociáció ellenére (a=1) a vezetöképesség csökken.
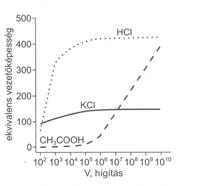
46. ábra. Erös és gyenge elektrolitok ekvivalens vezetöképességének
változása a hígítással
A vezetöképesség-csökkenés magyarázható az egymáshoz viszonylag közel esö hidratált ionok elektrosztatikus kölcsönhatásával. A kationok és az anionok akadályozzák egymás mozgását, mivel az elektromos erötérben ellentétes irányba mozognak.
Az elektrolitok tömény oldatában az
ionok elektrosztatikus kölcsönhatása a koncentrációval és a töltéssel arányos.
Az elektrolitokat ilyen szempontból az ún. ioneröséggel (I)
jellemezhetjük, amely definíció szerint az ionok koncentrációja (c1,
c2, c3.....ci) és töltése négyzetének (![]() ) szorzata:
) szorzata:
I = 1/2 ˇ
(c1ˇ ![]() + c2ˇ z
+ c2ˇ z![]() + c3ˇ z
+ c3ˇ z![]() + ..... ci ˇ z
+ ..... ci ˇ z![]() ) = 1/2 ˇ
) = 1/2 ˇ
Az elektrolitok vezetöképessége az ionok száma mellett függ az ionok méretétöl, töltésétöl és mozgékonyságától.(Lásd15. táblázat). A H+ és az OH mozgékonysága lényegesen nagyobb, mint az összes többi hasonló nagyságú ioné. A H+ vizes oldatban H3O+ formában van jelen, melynek mérete alapján a K+-hoz hasonló mozgékonyságúnak kellene lennie. A H3O+ lényegesen nagyobb mozgékonysága a H3O+ és a vízmolekulák kölcsönhatásával, valamint a víz nagyszámú molekulára kiterjedö hidrogénkötéseivel magyarázható, ami lehetövé teszi a protonok átadását a vízmolekulák között. Ennek következtében a proton csak átadódik egyik vízmolekuláról a másikra, tehát valójában nem teszi meg az elektródhoz vezetö utat. Az OH ionok szintén rendellenesnek tünö mozgékonysága hasonló mechanizmussal magyarázható.
15. táblázat. Az ionok mozgékonyságáról 18 C-on
Ionok |
Mozgékonyság (cm/s) |
Kationok |
|
|
H+ |
|
|
Na+ |
|
|
K+ |
|
|
Cu2+ |
|
|
Ag+ |
|
Anionok |
|
|
OH |
|
|
Cl |
|
|
|
|
|
CH3COO |
|
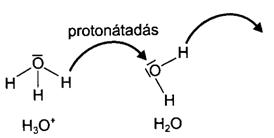
A Brönsted-Lowry-féle sav-bázis elmélet
A Brönsted-féle elmélet szerint savak mindazok a molekulák vagy ionok, amelyek protont képesek leadni, bázisok pedig azok, amelyek protont képesek felvenni (protondonorok ill. protonakceptorok). A sav-bázis reakció tehát mindig a kémiai rendszerek közötti protonmegoszlás, amely új sav és új bázis keletkezéséhez vezet. Az összetartozó sav-bázis párokat konjugált sav-bázis pároknak, a sav-bázis reakciókat protolitikus reakcióknak, a protonmegoszlást kifejezö egyensúlyt pedig protolitikus egyensúlynak nevezzük. Általános egyenlettel kifejezve:
![]() Asav(1 ) Bbázis(1) + H+
Asav(1 ) Bbázis(1) + H+
![]() H+ + Bbázis(2) Asav(2)
H+ + Bbázis(2) Asav(2)
![]() Asav(1) + Bbázis(2)
Bbázis(1) + Asav(2)
Asav(1) + Bbázis(2)
Bbázis(1) + Asav(2)
Az elmélet szerint a molekulák és ionok sav-bázis jellege nem abszolút, hanem a kémiai körülményektöl (reakciópartnertöl) függö tulajdonság.
Protonleadás csak akkor lehetséges egy sav részéröl, ha jelen van egy bázis, amely a protont felveszi; tehát a savak konjugált bázissá és a bázisok konjugált savvá történö átalakulása egy reakción belül játszódik le. A sav-bázis folyamat két bázisnak a protonért folytatott versengéseként is felfogható.
![]() Sav1 + Bázis2 Bázis1
+ Sav2
Sav1 + Bázis2 Bázis1
+ Sav2
![]() HCl + H2O Cl + H3O+
HCl + H2O Cl + H3O+
![]()
![]() +
+ ![]() NH3 +
NH3 + ![]()
![]() H3O+ + OH H2O
+ H2O
H3O+ + OH H2O
+ H2O
![]() H2O + NH3 OH +
H2O + NH3 OH + ![]()
A savakat és a bázisokat a Brönsted-féle elmélet szerint az alábbiak szerint csoportosíthatjuk:
*Neutrális savak, pl. a sósav, kénsav és salétromsav:
![]() HCl H++ Cl
HCl H++ Cl
![]() H2SO4 H+
+
H2SO4 H+
+ ![]()
![]() HNO3 H+
+
HNO3 H+
+ ![]()
*Anionsavak, pl. hidrogén-szulfát-ion:
![]()
![]() H+ +
H+ + ![]()
*Kationsavak, pl. az ammóniumion:
![]()
![]() H+
+ NH3
H+
+ NH3
*Neutrális bázisok, pl. ammónia:
NH3 + H+ = ![]()
*Anionbázisok, pl. cianid-, hidroxid-, karbonát- és hidrokarbonát ionok :
CN + H+ = HCN
OH + H+ = H2O
![]()
![]() + H+
+ H+ ![]()
![]()
![]() + H+ H2CO3
+ H+ H2CO3
*Kationbázisok, pl. hidratált alumíniumion:
Al(H2O)5(OH) + H+ = Al(H2O)6
Míg az Arrhenius-féle elmélet csak a vizes rendszerekben lejátszódó sav-bázis folyamatokra alkalmazható, addig a Brönsted-féle elmélet a sav-bázis folyamatokat az összes protolitikus rendszerben általánosan írja le. Jól példázzák ezt a perklórsav, a víz, az ecetsav és az etilalkohol közti protolitikus folyamatok:
![]() HClO4 + H2O
HClO4 + H2O ![]() + H3O+
+ H3O+
![]() ClO4 + CH3COOH
ClO4 + CH3COOH ![]() + CH3COOH
+ CH3COOH![]()
![]() HClO4 + C2H5OH
HClO4 + C2H5OH ![]() + C2H5OH
+ C2H5OH![]()
Az Arrhenius-elmélet szerinti savak
és bázisok a Brönsted-Lowry-elmélet szerint is savaknak és bázisoknak
tekinthetök. Ez utóbbi azonban a savak körét kiterjeszti a proton
leadására képes ionokra (![]() ,
,![]() ), a bázisok körét pedig kiterjeszti a proton megkötésére
képes ionokra (
), a bázisok körét pedig kiterjeszti a proton megkötésére
képes ionokra (![]() ,
, ![]() ), valamint a molekulákra (H2O) is. Számos anyag
savként és bázisként is reakcióba léphet a reakciópartner protonaffinitásától
függöen. Ezeket az anyagokat amfoter vegyületeknek nevezzük. Ilyen pl. a H2O,
az ammónia, a
), valamint a molekulákra (H2O) is. Számos anyag
savként és bázisként is reakcióba léphet a reakciópartner protonaffinitásától
függöen. Ezeket az anyagokat amfoter vegyületeknek nevezzük. Ilyen pl. a H2O,
az ammónia, a ![]() , a
, a ![]() , az Al (OH)
, az Al (OH)
Autoprotolízis
Számottevö dipólusmomentummal rendelkezö ún. poláros oldószerek molekulái között sajátos protonmegoszlás alakul ki. Az alábbi egyenletekböl látható, hogy ennek hátterében a Brönsted-Lowry-elmélet szerint értelmezhetö sav-bázis folyamatok állnak.
![]() 2 H2O OH + H3O+
2 H2O OH + H3O+
![]() 2
CH3COOH CH3COO + CH3COOH
2
CH3COOH CH3COO + CH3COOH![]()
![]() 2 C2H5OH C2H5O + C2H5OH
2 C2H5OH C2H5O + C2H5OH![]()
Ha
egy ilyen oldószerben hozzá képest savas vagy bázikus karakterü anyagot
feloldunk, az oldószerkationok (H3O+, CH3COOH![]() , C2H5OH
, C2H5OH![]() ) ill. az oldószeranionok (OH , CH3COO , C2H5O ) túlsúlyba kerülnek:
) ill. az oldószeranionok (OH , CH3COO , C2H5O ) túlsúlyba kerülnek:
![]() CH3COOH + HClO4 CH3COOH
CH3COOH + HClO4 CH3COOH![]() + ClO
+ ClO![]()
bázis sav oldószerkation
![]() CH3COOH + H2O CH3COO + H3O+
CH3COOH + H2O CH3COO + H3O+
sav bázis oldószeranion
Ezek szerint adott oldószer esetén azok az anyagok tekinthetök savaknak és bázisoknak, amelyek az oldószerkationok ill. az oldószeranionok számát növelik.
Savak és bázisok erössége
A Brönsted-Lowry-elmélet szerint a savak és bázisok erösségét a protonkötö képesség szabja meg. Az erös savak könnyen adnak le protont, az erös bázisok pedig nagy protonkötö képességgel rendelkeznek. Ebböl következöen erös savakból proton leadással gyenge konjugált bázis, erös bázisból pedig protonfelvétellel gyenge konjugált sav képzödik. A 19. táblázat a konjugált sav-bázis párok erösségét mutatja.
A savak és bázisok relatív erössége szabja meg, hogy egy sav-bázis reakcióban a kiindulási anyagok teljesen átalakulnak-e a megfelelö konjugált savvá ill. bázissá, vagy a reakció egyensúlyra vezetve, a keletkezö konjugált sav-bázis pár mellett a kiindulási sav és bázis egy része is megtalálható a reakcióelegyben. A legnagyobb gyakorlati jelentösége a savak és bázisok vizes közegben mutatott relatív erössége összehasonlításának van. Savak és bázisok abszolút erösségét pedig a vizes oldataikban kapott disszociációs egyensúlyok segítségével hasonlíthatjuk össze.
16. táblázat. A konjugált sav-bázis párok erössége
Sav Bázis
Erös sav HClO4 ![]() Gyenge bázis
Gyenge bázis
H2SO4 HSO![]()
HI I
HBr Br
HCl Cl
HNO3 NO![]()
H3O+ H2O
HSO![]() SO
SO![]()
H3PO4 H2PO![]()
HNO2 NO![]()
HF F
CH3COOH CH3COO
H2CO3 HCO![]()
H2S HS
HCN CN
NH![]() NH3
NH3
HS S2
H2O OH
NH3 NH![]()
Gyenge sav H2 H Erös bázis
A 16. táblázatban a víz felett lévö ionok protonkötö képessége kisebb mint a vízé, ezért ezek az ionok gyengébb bázisok, mint a víz. Ezért ezeknek az ionoknak megfelelö konjugált savak (HNO3, HCl) vízben történö oldódása során a savak ionizációja teljesen lejátszódik:
![]()
![]() HCl(g) + H2O(l) H3O+ + Cl HNO3(l)
+ H2O(l) H3O+ + NO
HCl(g) + H2O(l) H3O+ + Cl HNO3(l)
+ H2O(l) H3O+ + NO![]()
Ennek megfelelöen, a 18. táblázatban a H3O+ felett lévö savak erös savak, az ezeknek megfelelö konjugált bázisok pedig gyenge bázisok. A táblázatban a víz alatt lévö bázisok (F , CN ) a víznél erösebb bázisok, a nekik megfelelö konjugált savak (HF, HCN) pedig a H3O+-nál gyengébb savak. Vizes oldatukban a relatív sav- ill. bázis erösségének megfelelö egyensúly alakul ki:
![]()
![]() HF(l) + H2O(l) F + H3O+ HCN(g) + H2O(l) CN + H3O+
HF(l) + H2O(l) F + H3O+ HCN(g) + H2O(l) CN + H3O+
Ennek következtében a gyenge savak vizes oldatukban csak részlegesen disszociálnak, a disszociációfokot a sav konjugált bázisa és a víz közötti báziserösség viszonya szabja meg.
A 16. táblázatban az OH alatt felsorolt anionok a hidroxid ionnál erösebb bázisok, ezért ezen ionoknak vízzel való reakciója a víz protonjainak megkötését eredményezi:
H2O(l) + NH![]() = OH + NH3(g)
= OH + NH3(g)
H2O(l) + H = OH + H2(g)
A 16. táblázatban az OH felett, de a víz alatt lévö bázisok az OH -nál gyengébbek, de a víznél erösebbek; ezen bázisok és a víz között az alábbi reakciók játszódnak le:
![]() H2O(l) + F OH + HF(l)
H2O(l) + F OH + HF(l)
![]() H2O(l) + CN OH + HCN(g)
H2O(l) + CN OH + HCN(g)
A fentiek miatt a gyenge savak (HF,
HCN) jól disszociáló sóinak (NaF, KF) oldódása növeli az OH-
koncentrációt a H3O+-hoz képest. Ezzel szemben a gyenge
bázisokból képzödö sók (NH4Cl) kation komponense (NH![]() ) vizes oldatban növeli a H3O+
koncentrációt az OH
koncentrációhoz képest az alábbiak szerint:
) vizes oldatban növeli a H3O+
koncentrációt az OH
koncentrációhoz képest az alábbiak szerint:
![]() NH
NH![]() + H2O(l) NH3(g) + H3O+
+ H2O(l) NH3(g) + H3O+
A kémiai kötés és savi erösség
A savak protonleadó képességét a hidrogénatomnak a molekulában az egyéb atomokkal kialakított kötéseinek erössége és jellege határozza meg.
A periódusos rendszer egy oszlopában lefelé haladva a savi erösség fokozódik. Így pl. a hidrogénnek az oxigéncsoport elemeivel alkotott vegyületeinek savi erössége a következö: H2O< H2S<H2Se<H2Te. Ennek az az oka, hogy az atomok átméröjének növekedése csökkenti a hidrogénnel alkotott kötés energiáját, elösegítve ezzel a proton disszociációját. A periódusokban a savi erösséget a hidrogénhez kapcsolódó atomok elektronegativitása határozza meg (N<O<F), ezért a savi erösség sorrendje: NH3<H2O<HF.
A oxosavak esetén a savi erösség annál nagyobb, minél nagyobb az oxigénhez kapcsolódó atom elektronegativitása: HOCl>HOBr>HOI. Ennek nyilvánvaló oka az, hogy a nagyobb elektronegativitású X atom nagyobb mértékben polarizálja ill. gyengíti a hidrogén és az oxigén közötti kötést.
A többértékü protont tartalmazó savak disszociációja több lépésben játszódik le:
![]()
![]() H2SO4 H+ + HSO
H2SO4 H+ + HSO![]() HSO
HSO![]() H+ + SO
H+ + SO![]()
![]()
![]() H3PO4 H+ + H2PO
H3PO4 H+ + H2PO![]() H2PO
H2PO![]() H+ + HPO
H+ + HPO![]()
![]() HPO
HPO![]() H+ + PO
H+ + PO![]()
A HSO![]()
![]() , a H2PO
, a H2PO![]() és a HPO
és a HPO![]() gyengébb sav, mint a H2SO4 vagy a H3PO4,
mivel az ion negatív töltése a protonra nagyobb vonzóerövel hat, mint a
semleges molekula. Ezért a savi erösség sorrendje: H2SO4>HSO
gyengébb sav, mint a H2SO4 vagy a H3PO4,
mivel az ion negatív töltése a protonra nagyobb vonzóerövel hat, mint a
semleges molekula. Ezért a savi erösség sorrendje: H2SO4>HSO![]() és H3PO4>H2PO
és H3PO4>H2PO![]() >HPO
>HPO![]() .
.
A Lewis-féle sav-bázis elmélet
A Brönsted-Lowry-féle elmélet azokat a sav-bázis reakciókat írja le, ahol a reakciópartnerek között protonok átadása történik. Mind az Arrhenius- mind a Brönsted-Lowry-elmélet szerint a sav-bázis reakciókra jellemzö hogy:
*a reakció gyors, pillanatszerü,
*a reakció a savas és bázikus tulajdonságok egyidejü megszünését eredményezi, ezért a sztöchiometrikus reakció végpontja indikátorral jelezhetö,
*erös savak ill. bázisok a gyenge savakat ill. bázisokat sóikból felszabadítják,
*savak és bázisok több kémiai reakciót katalizálhatnak.
A Brönsted-Lowry-féle protolitikus elmélet a klasszikus sav-bázis fogalmat nagymértékben kiterjesztette, hátránya azonban az, hogy a sav-bázis funkciót proton jelenlétéhez köti, holott olyan vegyületek is lehetnek savas ill. bázikus tulajdonságúak, amelyek hidrogént nem is tartalmaznak. Ilyen pl. kalcium-oxid és a szén-dioxid egyesülése mészkövé, vagy a nátrium-oxid és a szilícium-dioxid egyesülése nátrium-szilikáttá.
Lewis továbbfejlesztette a sav-bázis reakciók elméletét olymódon, hogy a szóbanforgó folyamatokat protoncsere helyett elektronpár cserével magyarázza. Szerinte bázisok azok az anyagok, amelyeknek szabad reakcióképes elektronpárjuk van (elektrondonorok), és savak azok, melyek szabad elektronpár felvételére képesek (elektronakceptorok). Semlegesítés során tehát koordinatív kovalens kötés jön létre a reakciópartnerek között. Pl.:
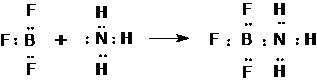
A Lewis-féle elmélet szerint számos olyan anyag nevezhetö savnak ill. bázisnak, amelynek jellegét ilyen értelemben másként nem tudjuk magyarázni. Lewis-féle sav pl. a bór-trifluorid, az alumínium-klorid és az ón(IV)-klorid.
A savak Lewis-féle definíciója általánosabb a Brönsted-féle meghatározásnál, mert oldószertöl függetlenül mindazokat az anyagokat magában foglalja, amelyekben valamely atom- vagy atomcsoport külsö elektronhéja nem lezárt. Az elmélet átfogóbb voltát bizonyítja, hogy a fémionok komplexképzö reakcióit is sav-bázis folyamatként képes értelmezni: a fémkation a sav, a ligandum pedig a bázis:
Fe2+ + 6 H2O = Fe(H2O)6 2+
Cu2+ + 4 NH3 = Cu(NH3)4 2+
Ag+ +2 NH3 = Ag(NH3)2 +
Ni2+ + 4 CN = Ni(CN)4 2-
A Lewis-féle elmélet hátránya, hogy nem értelmezhetö általa savaknak azok az anyagok, amelyeket egyébként protonleadó képességük folytán savnak tekintünk (sósav, salétromsav, kénsav stb.). Így ezeket H-savak néven külön csoportba foglaljuk.
A Lewis-féle sav-bázis elméletnek különösen a komplex vegyületek kémiájában, valamint a sav- vagy bázis katalizálta szerves kémiai reakciókban van nagy jelentösége. Az elözöekben nem említett néhány sav-bázis reakció egyenlete az alábbi:
Lewis-sav + Lewis-bázis = Lewis sav-bázis komplex
AlCl3 + Cl = AlCl![]()
CO2 + OH = HCO![]()
SO3 + BaO = BaSO4
Találat: 13281